Berlin –
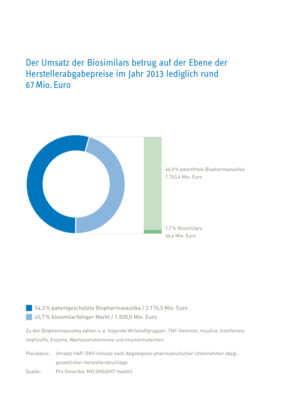
- Im Jahr 2013 betrug der Umsatz aller Biopharmazeutika, die zu Gunsten der GKV-Versicherten abgegeben wurden zu Werkspreisen rund 4 Milliarden Euro.
- Davon ist für Biopharmazeutika mit einem Umsatzvolumen von 1,76 Milliarden Euro der Patentschutz bereits abgelaufen – hierzu zählen z. B. bestimmte Impfstoffe, Insuline und Interferone.
- In den kommenden Jahren laufen mit einem Umsatzvolumen von über einer Milliarde Euro erstmals mehr biopharmazeutische Arzneimittel aus dem Patent als chemisch-synthetisch hergestellte Präparate.
Biopharmazeutische Arzneimittel treiben die Ausgaben der gesetzlichen Krankenkassen. Daher kommt ihrem Patentablauf eine besonders große Bedeutung zu. Denn nach dem Patentablauf können Biosimilars als Nachfolgeprodukte der ehemals patentgeschützten Biopharmazeutika für die Versorgung bereitgestellt werden. Und die bisherige Erfahrung in Deutschland zeigt, dass dann die Versorgung der Patienten bei gleicher Qualität für die Krankenkassen deutlich günstiger werden kann – wenn dafür die richtigen Voraussetzungen getroffen werden.
Für ein Umsatzvolumen von 1,76 Milliarden Euro ist der Patentschutz bereits abgelaufen. Im kommenden Jahr wird dann mit einem Umsatz von über einer Milliarde Euro erstmals mehr biopharmazeutischer Umsatz patentfrei als Umsatz chemisch-synthetisch hergestellter Arzneimittel.
Biosimilarunternehmen haben daher längst die Weichen gestellt, um möglichst frühzeitig zum Patentablauf Biosimilars für die Versorgung bereitstellen zu können. Daher liegt seit dem Herbst 2013 mit Infliximab die erste europaweite Zulassung für einen biosimilaren monoklonalen Antikörper vor. In vielen Ländern Europas kann Infliximab bereits für die Versorgung eingesetzt werden – in Deutschland wird dies erst dann der Fall sein, wenn sämtliche Schutzrechte des Erstanbieters abgelaufen sind.
Die mit 7-10 Jahren sehr lange Entwicklungsdauer und die enormen Investitionskosten für die Entwicklung eines Biosimilars von bis zu 200 Millionen US-Dollar erfordern faire Chancen, um im Wettbewerb bestehen zu können. Dies ist bei patentfreien Biopharmazeutika derzeit nicht der Fall.
Gute Gründe also, den Biosimilars jetzt den Weg zu ebnen. Ein Beispiel hierfür ist die Neueinstellung von Patienten. Die Arzneimittelkommission der deutschen Ärzteschaft spricht sich hier z. B. dafür aus, diese mit Biosimilars vorzunehmen. Krankenkassen und Ärzte haben sich so in Sachsen und Bremen bereits vertraglich auf diesen Ansatz geeinigt. In anderen Regionen Deutschlands ist das allerdings bislang nicht der Fall. Ergebnis: Dort muss mehr Geld ausgegeben werden, um die gleiche Versorgungsqualität zu erreichen. Geld, das an anderer Stelle sinnvoll eingesetzt werden könnte.